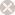AAV包装技术服务
文件下载一、腺相关病毒(Adeno-Associated Viral Vector,AAV)简介
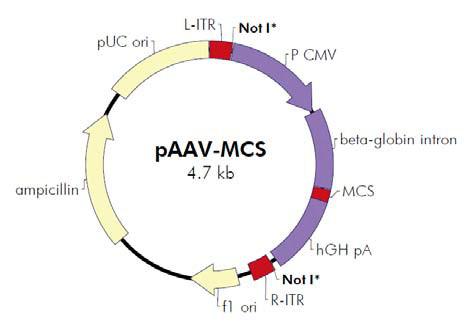
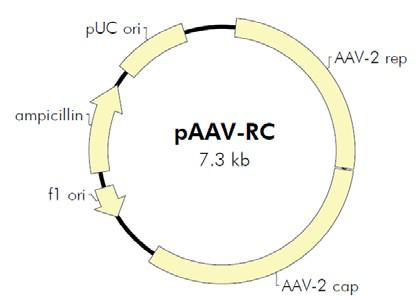
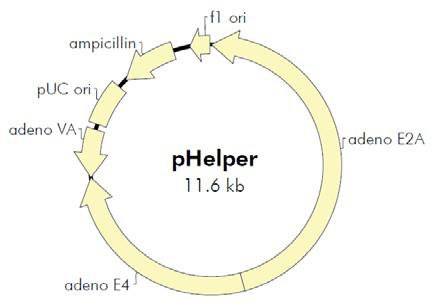
图1. AAV 基因组结构 二、腺相关病毒的优点 三、重组腺相关病毒载体系统简介 图2. AAV Helper-Free System腺相关病毒系统 三、重组腺相关病毒载体不同血清型 研究发现 AAV 具有多种血清型,各种不同血清型的 AAV 载体的主要区别是 衣壳蛋白不同,因此对不同的组织和细胞的转染效率存在差异。目前靖瑞百康生物在包装腺相关病毒时只有AAV2的 血清型可供客户选择,其他针对 不同 组织器官相应血清型的 AAV 病毒,见表 1。 血清型 组织亲和性 AAV1 肌肉,心脏,骨骼肌(包括心肌),神经组织 AAV2 中枢神经,肌肉,肝脏,脑组织,眼, AAV3肌肉,肝脏,肺,眼 AAV4 中枢神经,肌肉,眼,脑 AAV5 肺,眼,中枢神经,关节滑膜,胰腺 AAV6 肺,心脏 AAV7 肌肉,肝脏 AAV8 肝脏,眼,中枢神经,肌肉 表1. 不同血清型AAV对各组织器官细胞的亲和性 Cell Line AAV-1 AAV-2 AAV-3 AAV-4 AAV-5 AAV-6 AAV-8 AAV-9 AAV-DJ AAV-DJ/8 Huh-7 13 100 2.5 0 0.1 10 0.7 0 500 0.2 HEK293 25 100 2.5 0.1 0.1 5 0.7 0.1 500 0.3 HeLa 3 100 2 0.1 6.7 1 0.2 0.1 667 0.2 HepG2 3 100 16.7 0.3 1.7 5 0.3 ND 1250 0.5 Hep1A 20 100 0.2 1 0.1 1 0.2 0 400 0.1 911 17 100 11 0.2 0.1 17 0.1 ND 500 0 CHO 100 100 14 1.4 333 50 10 1 25000 5 COS 33 100 33 3.3 5 14 2 0.5 500 0.3 MeWo 10 100 20 0.3 6.7 10 1 0.2 2857 1 NIH3T3 10 100 2.9 2.9 0.3 10 0.3 ND 500 0.1 A549 14 100 20 ND 0.5 10 0.5 0.1 1000 0.1 HT1180 20 100 10 0.1 0.3 33 0.5 0.1 333 0.2 Monocytes 1111 100 ND ND 125 1429 ND ND 100 ND Immature DC 2500 100 ND ND 222 2857 ND ND 200 ND Mature DC 2222 100 ND ND 333 3333 ND ND 100 ND 表 2. 不同血清型 AAV 感染体外培养细胞比较 1、设置温度为37~42℃的水浴。 2、查看细胞库记录,根据记录从液氮罐中取出冻存的细胞(需戴上棉手套,防 止被冻伤),迅速丢入水浴锅中并快速晃动,尽量在1~2min 内使细胞溶液完全 溶解。 3、将细胞溶液转移到15ml 离心管中,并在其中加上1ml 新鲜的完全培养基,混 匀后离心,1000 rpm/min,5min。 4、去掉上清,加入5ml 新鲜的完全培养基,混匀沉淀后,转入6 cm 培养皿。 5、将培养皿平稳放入37℃、5% CO2 和95%相对湿度的培养箱中培养。 6、第二天观察细胞存活率。给细胞换一下培养基。以后每天观察细胞生长情 况。 (四)AAV包装和浓缩 1. 质粒扩增构建好的AAV载体、包装质粒和辅助质粒需经过大量抽提, 浓度大于1ug/ul, A260/280 在1.7-1.8 间方可用以包毒。推荐使用Qiagen 大抽试剂盒进行质粒的大量去 内毒素抽提。 2. 传AAV-293细胞将培养AAV-293 细胞T75 瓶中的培养基吸净,加入2mL 4 度冰箱取出的0.25%胰酶,使其均匀覆盖瓶底,置于37 度培养箱中3-5min,取出,摇晃可发现细胞于底部脱 离,将其全部晃下,加入3mL 37 度水浴中预热的10% DMEM,移液枪用10mL 移液 管进行吹打,较大力吹打6-8 次即可,不留死角,瓶口处较难吹打可将移液管对准培 口,小力将培养基打出即可覆盖到接近瓶口的细胞。之后,将所有细胞吸出,置于 15mL 离心管中,取50ul 混匀后的细胞于1.5mL eppendorf 管中,加入450ul 10% DMEM,即为10 倍稀释,混匀,取10ul 细胞于计数板中计数。计数板上共4 大格,每 大格16 小格。计数时,4 大格均计数,总数除以4(得每大格细胞数),再乘以10(10 倍稀释),即为实际n 万/mL 细胞浓度。传代当天记为第一天,若第二天进行转 染,铺900-1000 万/T75;若第三天转染,铺350-400 万/T75。每瓶T75 加10mL 10% DMEM 培养基。转染当天观察细胞密度,80-90%满即可进行转染。转染前无需换培 养基。 3. 做脂转complex 试剂名称 试剂数量 载体质粒 5ul(1.0ug/ul) 包装质粒 5ul(1.0ug/ul) 辅助质粒 5ul(1.0ug/ul) 注:Lipo 2000TM转染试剂为invitrogen产品,使用说明参考Lipo 2000TM说明书。 1) 向病毒浓缩液中添加固体 CsCl 直到密度为1.41 g/ml(折射率为1.372); 2) 将样品加入到超速离心管中,用预先配好的 1.41 g/ml CsCl 溶液将离心管剩 余空间填满; 3) 在 175,000 g 下离心24 小时,以形成密度梯度。按顺序分步收集不同密度的 样品,取样进行滴度测定。收集富集有AAV 颗粒的组分; 4) 重复上述过程一次。 5)将病毒装入100 kDa的透析袋,4度透析脱盐过夜。此即为纯化的AAV病毒 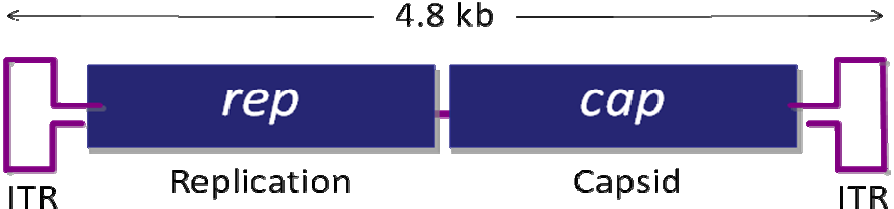
![]() AAV9 心脏,肌肉,肺(肺泡),肝脏,中枢神经
AAV9 心脏,肌肉,肺(肺泡),肝脏,中枢神经
(2)SYBR Green QPCR标准曲线精确定量(常规质控),报告结果通常如下图。
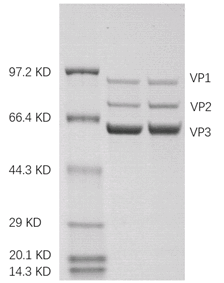
(3)SDS-PAGE电泳与考马斯亮蓝染色确定纯度(用于高纯度AAV的常规质控)。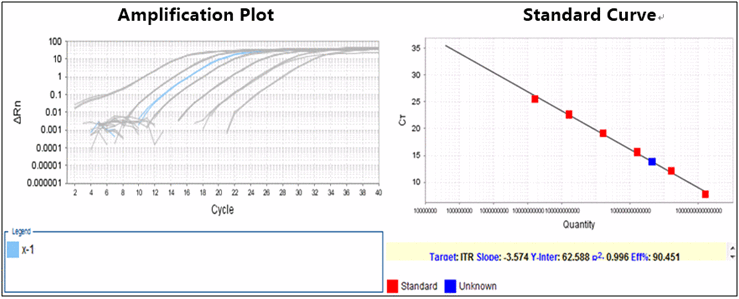
(5)电镜检测(用于高纯度AAV的可选质控,需额外3个工作日和费用¥400/样品)
(6)内毒素检测(用于高纯度AAV的可选质控,需额外3个工作日和费用¥1500+50×样品数)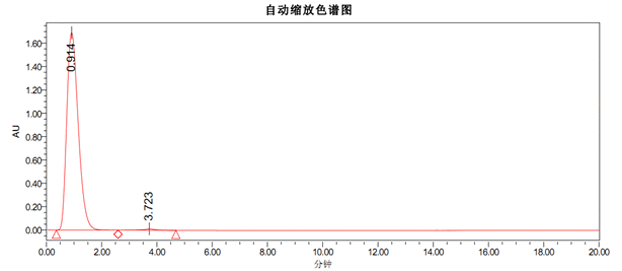
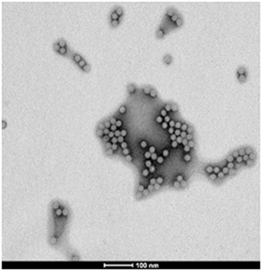
按峰面积比例计算纯度为99% 多视野统计结果出空壳率2%。